| ホーム | 最新情報 | 研究成果 | 学生の皆さんへ | 研究室見学 | 研究業績 |
A群レンサ球菌感染症の重症化メカニズムの解析(担当:寺尾豊)
はじめに
A群レンサ球菌Streptococcus pyogenes(group A streptococcus: GAS)は,血液含有寒天平板培地で培養すると完全溶血を呈する「溶血性レンサ球菌(俗称:溶レン菌)」である.溶血性レンサ球菌には,A,B,G群,および一部のC,D群が含まれる.これらの群別法は,細胞壁多糖抗原の血清型に基づいており,A群からU群(欠番あり)に分類されている.また,GASは,菌体表層に架橋するMタンパクの抗原性の違いから130種類以上の血清型に細分化されている.さらに近年では,Mタンパクの抗原決定部位の配列情報によるemm分類も行なわれており(文献1),そのプロトコールはアメリカ合衆国国立疾病対策センターのホームページでも公開されている.
http://www.cdc.gov/ncidod/biotech/strep/protocol_emm-type.htm
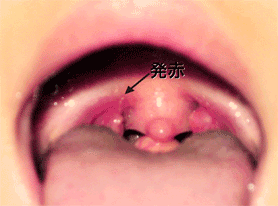

一般的にGASは,ヒトに炎症性疾患を引き起こすことが知られており,咽頭炎や扁桃炎などの局所性炎症を惹起するほか,猩紅熱や産褥熱などの全身性炎症の起因菌ともなる.時として,感染後にヒト組織成分と交叉反応を示す抗GAS抗体が産生され,急性糸球体腎炎やリウマチ熱などを誘発し,重篤化することがある.しかしながら,ペニシリン系の抗生物質が奏効することから,大きな注意を払われることは少なかった.
1980年代中頃から,血液や組織中にGASが侵入する侵襲性GAS感染症,および軟部組織壊死やショックを伴う劇症型GAS感染症(streptococcal toxic shock syndrome: STSS)が世界各国で報告され,注目を浴びるようになった.欧米にて「人喰いバクテリア」とも報道されたその衝撃的な病態は,多くの研究者をSTSS発症機序やGASの病原因子の解析に駆り立てることになった.その結果,これまで不明な点が多かったGAS感染成立のメカニズムや病態発症の機序が徐々に明らかにされてきた.本研究室でも,分子生物学的な手法を用いてGASの病原因子の解析を行ない,STSS発症過程について明らかにする試みを続けている.
A群レンサ球菌(溶連菌)感染症について参考となる総説
川端重忠 (2005) 化膿レンサ球菌の細胞付着・侵入機構に関する研究.日本細菌学雑誌.60: 365-374.
川端重忠 (2006). インフルエンザウイルスと細胞感染の合併による重症化機構.化学療法の領域.22: 72-77.
浜田茂幸,川端重忠 (2006). シリーズ・感染症と新たな闘い17 劇症型Aレンサ球菌感染症とその治療.日本薬剤師会雑誌 58: 49-52. 2006.
寺尾豊,川端重忠 (2006). 劇症型A群レンサ球菌感染症. Pharma Medica.メディカルレビュー社,24:43-46.
川端重忠,寺尾豊 (2007). 劇症型A群レンサ球菌感染症(劇症化の分子機構).BIO Clinica,北隆館,22: 39-44.
浜田茂幸,川端重忠,藤原卓 (2007). レンサ球菌感染症 劇症型疾患からう蝕まで.感染・炎症・免疫,37: 39-51.
川端重忠 (2007). 化膿レンサ球菌感染症の成立機構の解析.阪大歯学誌,51: 33-35.
川端重忠,山口雅也 (2007). A群レンサ球菌感染症のメカニズム.医学のあゆみ,医歯薬出版,223 (8): 601-605.
中田匡宣,寺尾 豊,川端重忠 (2007).レンサ球菌感染症に対する免疫療法の可能性.炎症と疾患,先端医学社,15:45-50
現在までの研究成果
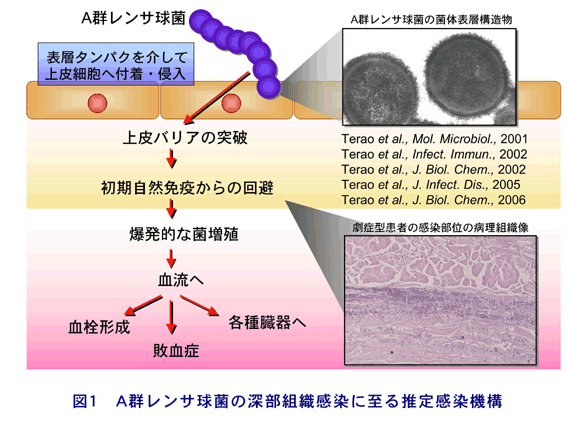
1. 細胞侵入機構
2007年3月23日現在,12菌株のGAS全ゲノム配列が,DDBJのホームページで公開されている.
http://gib.genes.nig.ac.jp/cmprtv/
これらのゲノムデータを利用することで,既存の生化学的手法では見出せなかった新たな病原因子が同定されている.
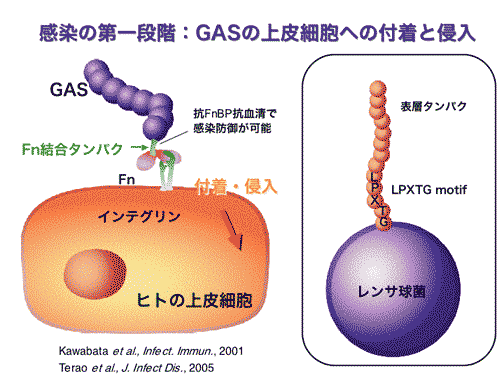
かつては細胞非侵入性細菌とされていたGASであったが,組織や血液中にGASが侵入することが,1990年代に欧米の研究者を中心に報告された.さらに,その侵入因子が分子レベルで次々と明らかにされ,GASは菌体表層タンパクであるフィブロネクチン(Fn)結合タンパクを介して宿主由来のFnと結合すること,およびFn結合タンパクこそがGASの主たる宿主細胞侵入因子であることが報告された.その後,我々を含めた各国の研究グループの手により,M血清型に相関する分布様式で複数のFn結合タンパクが同定された(文献2-5).さらに,それらの共通構造を解析することにより,上皮細胞への侵入機構も明らかとなった.その他にも,コラーゲンやラミニン(文献6)等の宿主由来成分を架橋分子として上皮細胞付着を補助すると考えられる分子群も同定されている.これらの分子機構を用いて,GASは宿主の上皮細胞バリアを突破し,組織中に侵入を果たすと考えられる.

2. 自然免疫系の回避機構
ヒトは,相互に作用し合う自然免疫系と獲得免疫系を備えることで,非常に強力な感染防御能力を発揮する.上皮細胞に侵入したGASがSTSSを発症するためには,深部組織へ移行した後に組織中で宿主免疫から逃れて増殖する必要がある.興味深いことに,STSSおよび侵襲性GAS感染症患者の感染部位においては,好中球の浸潤が低下することが報告されている.
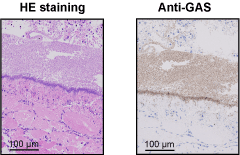 (Terao et al., J. Biol. Chem., 2008)
(Terao et al., J. Biol. Chem., 2008)
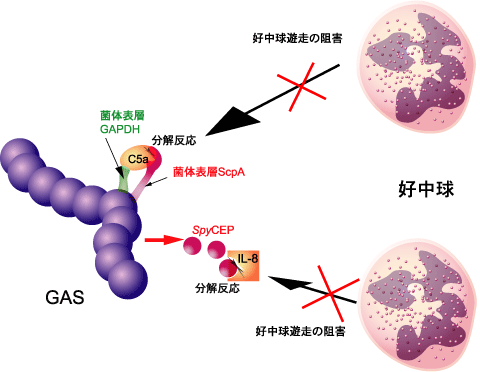
好中球は,感染の初めに補体成分C5aやインターロイキン(IL)-8の作用で遊走し,微生物を体内で増殖する前に排除する.したがって,GASの組織侵入直後に,好中球によるGAS貪食が阻害されることは,結果として急激な細菌増殖を招くことを示唆している.GASが初期免疫を逃れて増殖すると,宿主免疫系は対処しきれず,各種臓器への菌の伝播を許容し,STSSを引き起こすのではないかと推察している.近年,好中球遊走能を阻害するGASの機構が次々と明らかにされている.GASの菌体表層には,C5aを分解するセリンプロテアーゼScpA,およびC5aを捕獲してScpAに提示する分子GAPDHが存在する.我々は,ScpAとGAPDHの両分子は相互に作用することで,効率的にC5a不活化し,好中球の遊走を阻害することが明らかにした(文献7).さらに,イギリスとイスラエルのグループは,IL-8分解酵素SpyCEPを同定し,詳細な機能解析を進めている.
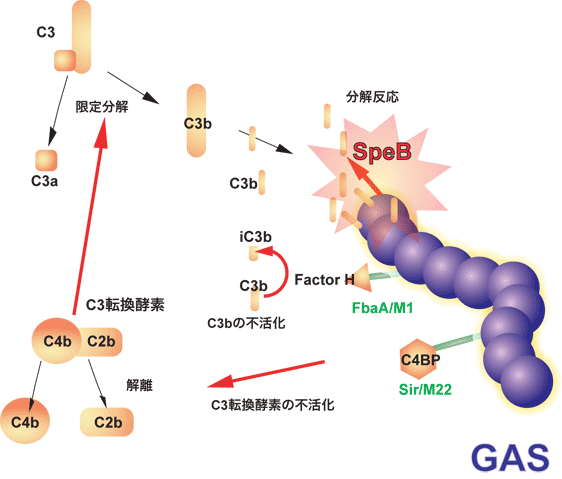
GASは好中球が感染巣に浸潤してきた場合にも,更なる自然免疫回避機構を備えて対抗している.感染微生物は補体C3bによってオプソニン化され,好中球やマクロファージに貪食されるが,GASは菌体表層に宿主H因子に結合するFbaA分子を発現している.H因子は宿主自身を自己の免疫系から守るための血清成分で,接触するC3bを不活化する働きがある.つまり,GASはH因子を菌体表層に結合することで,周囲のC3bを無力化し,抗オプソニン作用を発揮する可能性が考えられている.また,GASは補体カスケードの活性化系路で中心的な役割を果たすC3転換酵素を不活化する宿主成分C4BPも,その菌体表層に結合させることが報告されている.これらのことは,GASが周囲で展開される補体活性系路を多段階的に遮断できることを推測させる.
2008年に入り,我々を含めた国内外の研究グループにより,GASはシステインプロテアーゼ SpeBの作用でC3bを分解し,自然免疫から回避を図ることが示されている(文献8, 9).
3. 第三過程:獲得免疫系の回避
GASが様々な分子機構を駆使して自然免疫系を逃れても(文献8),宿主内にはより特異的かつ強力な獲得免疫系が存在する.しかしながら,GASはその獲得免疫に抗う様々な分子も菌体表層に発現している(免疫グロブリン結合タンパク等;文献10-12).菌体表層Mタンパクは,その抗原性の多様さゆえに血清型分類に頻用されている.すなわち,同一宿主に対しても異なる血清型GASの再感染を可能にしている.また,Mタンパクには宿主分子と相同性を示す領域が存在し,その交叉反応性により自己抗体の産生を促す可能性が指摘されている.
その他にもGAS表層には,ヒトのコラーゲンと類似構造を有するコラーゲン様タンパク質が複数存在する.これらの分子は,免疫原性が低いことから抗オプソニン化に寄与するだけでなく,ひとたび特異抗体が産生されると交叉反応を誘導する可能性も秘めている.また,菌体表層タンパク群の最外層を覆う莢膜ヒアルロン酸は,抗貪食作用を有することが知られている.しかも,抗原性が極めて低いことから特異抗体が誘導され難いという特徴も併せ持つ.
上述のように,GASは獲得免疫系には必須の非自己認識機構を欺く分子群を有している.これら分子群に関して,近年のトランスクリプトーム解析から,興味深い知見が得られている.GASは上皮細胞や血管内侵入前後で外界の環境が変化すると,それに呼応して菌体表層に発現させる分子セットを巧みに調節することが明らかになってきた.このような調節機構の存在は,GASが多段階の獲得免疫回避機構を有するだけでなく,状況に応じて自在に使い分けていることを推察させる.TOPへ
(Terao et al., J. Biol. Chem., 2008; Kuo et al., Infect. Immun., 2008)
4. 様々な外毒素の産生と感染の拡大
宿主免疫を回避したGASは,様々な外毒素を産生し,周囲の細胞や組織を傷害すると考えられる.SpeBは,その強力なタンパク質分解活性により軟部組織を破壊し,GASの深部組織への拡散を助けると推察される.さらに,宿主の内因性マトリックスメタロプロテアーゼを活性化することにより,炎症および組織破壊を進行させ,更なる感染拡大に拍車をかけることも報告されている.溶血毒素SLOおよびSLSは細胞を傷害し,病態の悪化に関与すると考えられる.その他にも,宿主の核酸を分解するストレプトドルナーゼや血液凝固系を阻害するストレプトキナーゼ産生することで,単一菌種としては異例なほど多彩な病態を引き起こすことが推察されている.物理的な組織破壊に加えて,宿主の恒常性を損なう結果,各種組織へのGAS拡散が容易になると考えられる.
5. STSSの発症へ
STSSの病態の特徴として,ショックが挙げられる.黄色ブドウ球菌による毒素性ショックとの相関から,その誘発因子の一つとしてスーパー抗原が考えられている.GASのスーパー抗原は,生化学的な手法により分離・同定されたSpeA,SpeC,SSAおよびMFに加え,ゲノム情報およびプロテインデータベースの相同検索から同定されたSpeG〜M,SMEZ1およびSMEZ2の14種類が報告されている.これらは,アミノ酸配列上の相同性は20〜30%程度に過ぎないものの,推定三次元立体構造は極めて類似している.単一の菌種でこれほどまでに多くのスーパー抗原を有することは稀であり,正常免疫システムの撹乱とショック発症に関与することが予測される.また,前述のプロテアーゼや溶血毒素等の作用により,軟部組織の破壊が進行し,STSSが成立すると考えられる.
今後の課題
現在までに,細菌側の病原因子を中心にSTSS発症機序を解析してきたが,感染症は宿主と細菌の相互作用のなかで成立するものである.したがって,GASの病原因子だけではSTSSの全容は説明できない.これまでに,ヒト白血球抗原の多様性とGAS感染後の重症化が関与することも報告されている.今後は,宿主因子を勘案したSTSS発症機構の解明と感染防御法の提案を行ないたいと考えている.
謝 辞
上述の研究成果は,科学研究費補助金,科学技術振興機構,21世紀COEプログラム等の研究助成金のサポートにより遂行された.
関連文献
- Murakami, J., S. Kawabata, Y. Terao, K. Kikuchi, K. Totsuka, A Tamaru, C, Katsukawa, K. Moriya, I. Nakagawa, I. Morisaki and S. Hamada. 2002. Distribution of emm genotypes and superantigen genes of Streptococcus pyogenes isolated in Japan, 1994-9. Epidemiol. Infect. 128(3): 397-404.
- Kawabata, S., E. Kunitomo, Y. Terao, I. Nakagawa, K. Kikuchi, K. Totsuka and S. Hamada. 2001. Systemic and mucosal immunizations with fibronectin-binding protein FBP54 induce protective immune responses against Streptococcus pyogenes challenge in mice. Infect. Immun. 69(2): 924-930.
- Terao, Y., S. Kawabata, E. Kunitomo, J. Murakami, I. Nakagawa, and S. Hamada. 2001. Fba, a novel fibronectin-binding protein from Streptococcus pyogenes, promotes bacterial entry into epithelial cells, and the fba gene is positively transcribed under the Mga regulator. Mol. Microbiol. 42(1): 75-86.
- Terao, Y., S. Kawabata, M. Nakata, I. Nakagawa and S. Hamada. 2002. Molecular characterization of a novel fibronectin-binding protein of Streptococcus pyogenes strains isolated from toxic shock-like syndrome patients. J. Biol. Chem. 277(49): 47428-47435.
- Terao, Y., S. Okamoto, K. Kataoka, S. Hamada and S. Kawabata. 2005. Protective immunity against Streptococcus pyogenes challenge in mice after immunization with fibronectin-binding protein. J. Infect. Dis. 192(12): 2081-2091.
- Terao, Y., S. Kawabata, E. Kunitomo, I. Nakagawa and S. Hamada. 2002. Novel laminin-binding protein of Streptococcus pyogenes, Lbp, is involved in adhesion to epithelial cells. Infect. Immun. 70(2): 993-997.
- Terao, Y., M. Yamaguchi, S. Hamada and S. Kawabata. 2006. Multifunctional glyceraldehyde-3-phosphate dehydrogenase of Streptococcus pyogenes is essential for evasion from neutrophils. J. Biol. Chem. 281(20): 14215-14223.
- Terao, Y., Mori, Y., Yamaguchi, M., Shimizu, Y., Ooe, K., Hamada, S. and Kawabata S. 2008. Group A streptococcal cysteine protease degrades C3 (C3b) and contributes to evasion of innate immunity. J. Biol. Chem., 283: 6253-6260.
- Kuo, C. F., Y. S. Lin, W. J. Chuang, J. J. Wu, and N. Tsao. 2008. Degradation of complement 3 by streptococcal pyrogenic exotoxin B inhibits complement activation and neutrophil opsonophagocytosis. Infect Immun. 76(3):1163-9.
- Kawabata, S., Y. Tamura, J. Murakami, Y. Terao, I. Nakagawa and S. Hamada. 2002. A novel, anchorless streptococcal surface protein that binds to human immunoglobulin. Biochem. Biophys. Res. Commun. 296(5): 1329-1333.
- Okamoto, S., Y. Terao, Y. Tamura, S. Hamada, and S. Kawabata. 2008. Streptococcal immunoglobulin-binding protein Sib35 exerts stimulatory and mitogenic effects toward mouse B lymphocytes. FEMS Microbiol. Lett., 281 (1): 73-80.
- Kunitomo, E., Y. Terao, S. Okamoto, T. Rikimaru, S. Hamada, and S. Kawabata. 2008. Molecular and biological characterization of histidine triad protein in group A streptococci. Microbes Infect., 10(4): 414-423.