化膿レンサ球菌のアルギニン代謝系が病態形成に果たす役割の解析
広瀬雄二郎
化膿レンサ球菌は、局所性化膿疾患から劇症型感染症などの致死性疾患まで様々な病態を引き起こす。本研究では、化膿レンサ球菌のアルギニン代謝系が病態形成に果たす役割を検討した。
アルギニン代謝活性を有する化膿レンサ球菌 血清型1型 5448株 (野生株WT) を用い解析を進めた。まず、THY液体培地中での成長過程における培地中グルコース濃度およびアルギニンデイミナーゼをコードするarcA遺伝子の発現量を評価した。その結果、定常期ではグルコースが枯渇し、対数増殖期と比較してarcAの発現が著しく上昇していた (図1Aおよび1B)。次に、実際に動物感染モデルにおいて病原性の違いに影響するかを検討するために、arcA遺伝子の欠失株 (ΔarcA) と復帰変異株 (Wr) を作製し、マウス敗血症モデルとマウス皮膚表面感染モデルに供試した。血液中はグルコース濃度が高く、皮膚表面はグルコースなどの糖質濃度が低いことが知られているためである。さらに、角質層を構成する主要なタンパク質であるフィラグリン由来のアルギニンが皮膚には豊富に含まれることも知られているためである。敗血症モデルでは、各菌株の感染によるマウス致死率に差は認められなかった (図2A)。一方、皮膚表面感染モデルでは、arcAの欠失により、皮膚潰瘍形成が抑制されるとともに皮膚病変中の生菌数が有意に減少した (図2Bおよび図2C)。また、感染局所におけるarcA欠失株では、溶血毒素をコードするsagA遺伝子およびslo遺伝子の発現量が有意に低下した (図2D)。グルコースを利用できない状態を再現するために、グルコースおよびアルギニン不含のDMEM培地を用い、アルギニン添加による化膿レンサ球菌の遺伝子発現変化をRNA-seq解析で検討した。その結果、アルギニン添加によりWTのみで溶血毒素を含む複数の病原因子の遺伝子発現量が上昇した (図3Aおよび図3B)。さらに、化膿レンサ球菌とヒト角化上皮細胞を共培養したところ、アルギニン添加により細胞傷害性が有意に増強された (図3Cおよび図3D)。
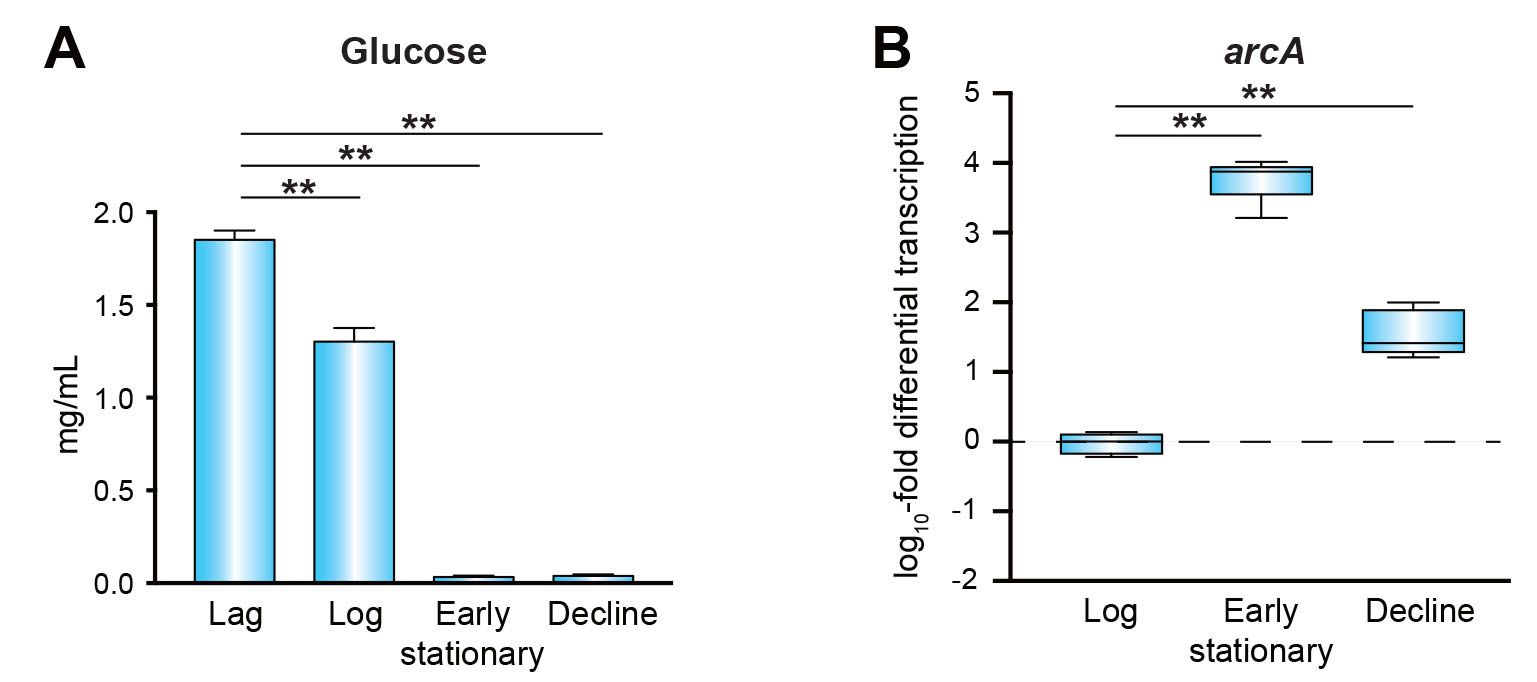
図1. マウス髄膜炎モデル感染24時間後の脳組織における肺炎球菌の局在.野生株および相補株感染マウスでは,肺炎球菌 (緑) が脳血管内皮細胞層 (赤) を突破している像が高頻度に確認された (矢印).
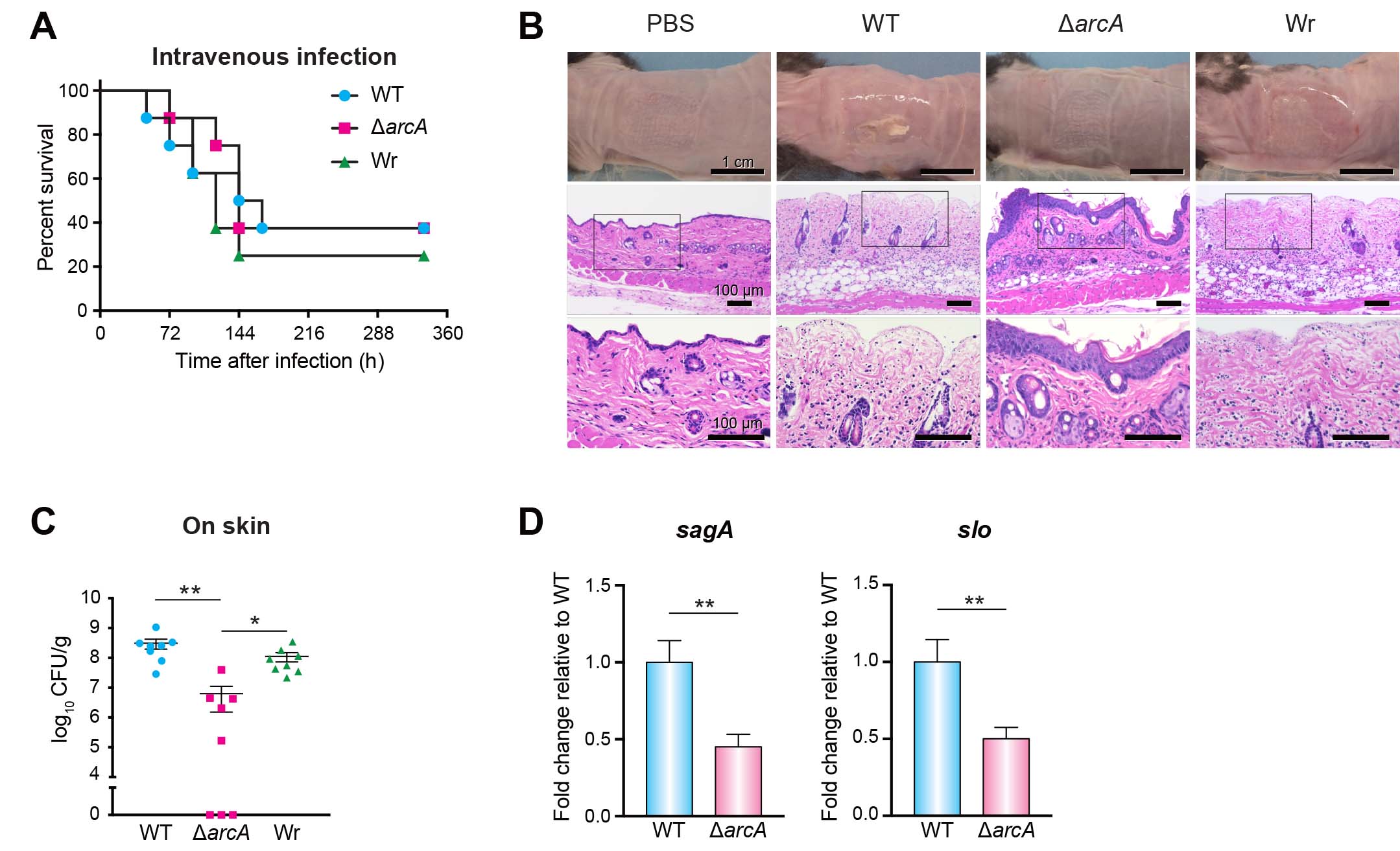
図2. 敗血症モデルでの致死率 (A).マウス皮膚表面感染モデルにおける感染3日後の組織像 (実際の病変とHE染色像) (B) および感染組織中のCFU (C).マウス皮膚表面感染モデルへ感染させ、感染1日目の化膿レンサ球菌のsagA遺伝子およびslo遺伝子の発現量 (D).
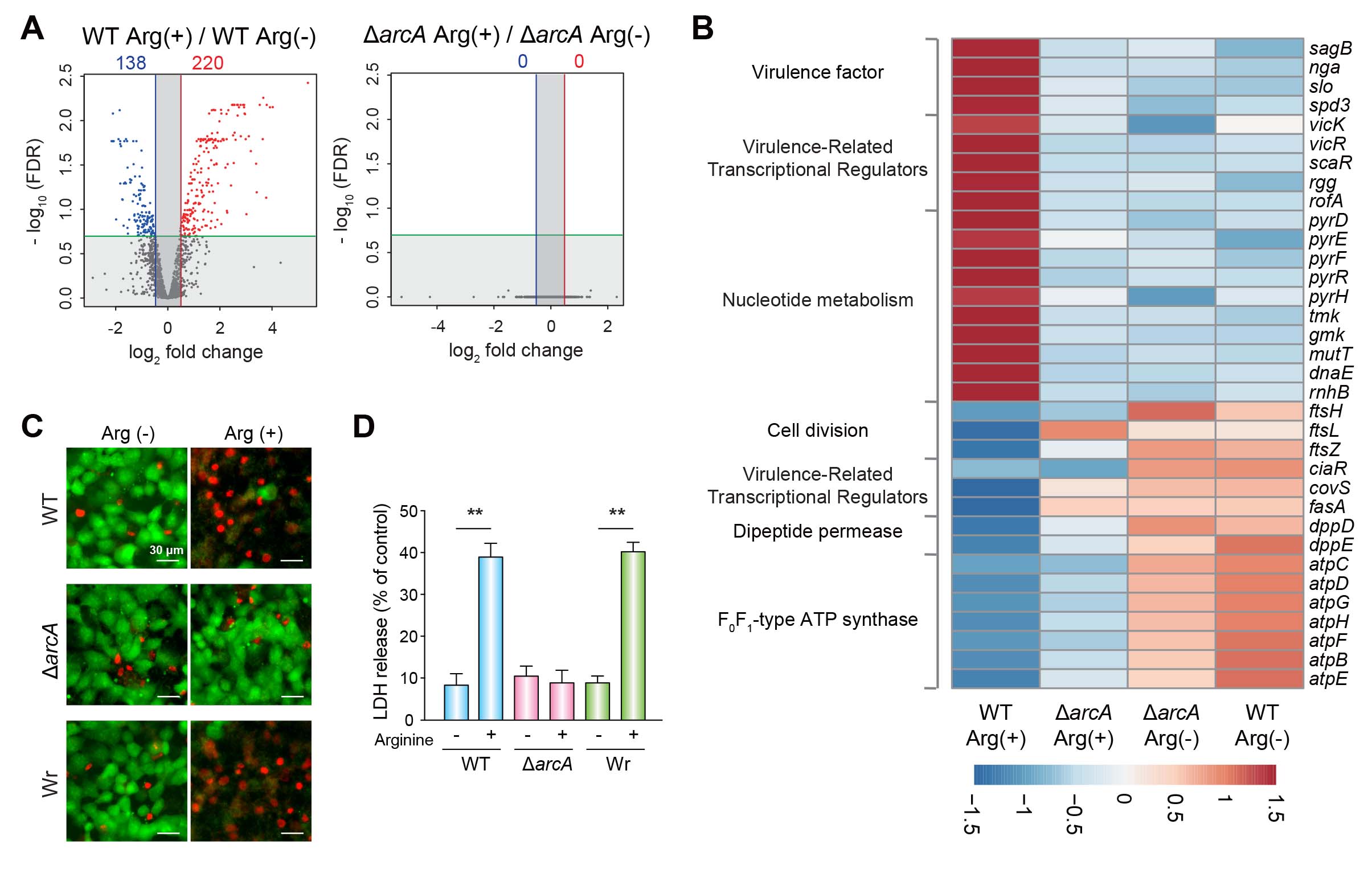
図3. グルコースおよびアルギニン不含のDMEM培地で培養中の化膿レンサ球菌の遺伝子発現変化 (A, およびB).化膿レンサ球菌とヒト角化上皮細胞の共培養実験による細胞毒性をLIVE/DEAD細胞生存率アッセイ (C) および細胞培養液の上清におけるLDHの定量 (D) にて評価.
以上の結果より、化膿レンサ球菌のアルギニン代謝能は、皮膚表面のようなグルコースを利用できない環境下で菌の生存と溶血毒素の発現に寄与することにより、病態を惹起することを明らかにした (図4)。
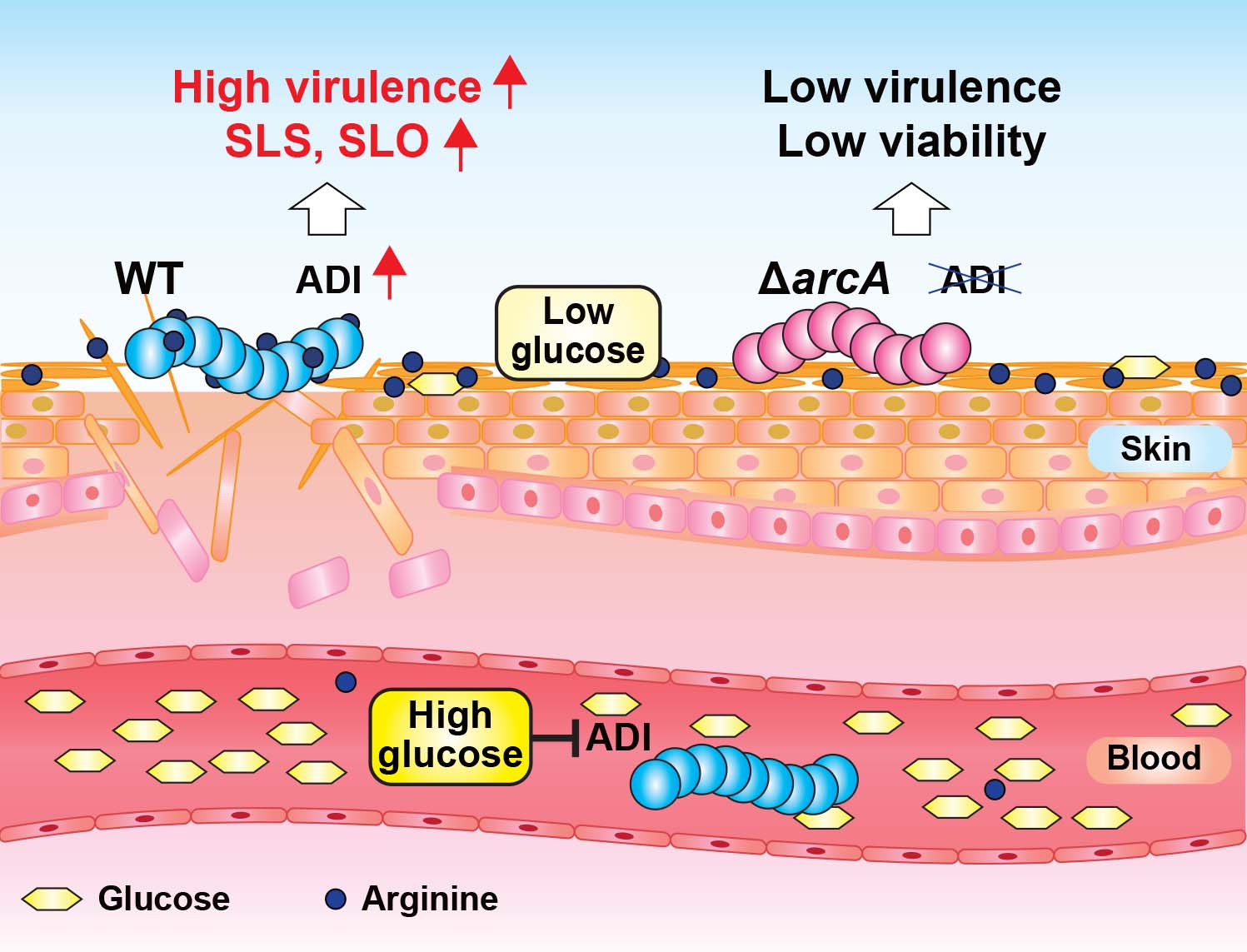
図4. まとめ.
【参考文献】
Hirose Y., Yamaguchi M., Sumitomo T., Nakata M., Hanada T., Okuzaki D., Motooka D., Mori Y., Kawasaki H., Coady A., Uchiyama S., Hiraoka M., Zurich R.H., Amagai M., Nizet V., Kawabata S. Streptococcus pyogenes upregulates arginine catabolism to exert its pathogenesis on the skin surface. Cell Rep 34: 108924. 2021.