化膿レンサ球菌のシステインプロテアーゼ SpeBによるヒト補体免疫回避機構
化膿レンサ球菌 (Streptococcus pyogenes) はヒト口腔や鼻腔から飛沫感染し,咽頭炎や膿痂疹などの比較的侵襲性の低い疾患から,壊死性筋膜炎や毒素性ショック症候群 (streptococcal toxic shock syndrome;STSS) と呼ばれる重篤な感染症に至るまで幅広い病態を引き起こす.同疾患の治療ではペニシリン系抗菌薬が主に用いられる.一方,ヒト補体制御因子のひとつであるC1 esterase inhibitor(C1-INH)を補助療法としてSTSS患者に投与し,症状が軽減した症例が報告されている.C1-INH欠損症とSTSS患者の症状には類似点がみられるが,STSS患者に対するC1-INH製剤の作用機序について不明な点が多い.そこで本研究では,化膿レンサ球菌の病原因子および C1-INHを含むヒト補体免疫系との相互作用を解析し,感染メカニズムとの関連を検討した.
S. pyogenes が産生する既知のプロテアーゼの組換え体をヒト血清と反応させたところ,主要な細胞壁分泌型システインプロテアーゼであるstreptococcal pyrogenic exotoxin B (SpeB) がC1-INHに対して高い分解能を示した.次に,10種のM血清型のS. pyogenes 株の培養上清画分をヒト血清と反応させ,各菌株におけるSpeB産生量とC1-INH分解能を比較した結果,SpeB産生量とC1-INH分解活性に相関が認められた.また,エドマン分解法を用いた解析より,SpeBはC1-INHのIle49とSer50間およびVal127とThr128間を分解することが明らかになった.さらに,SpeB組換え体と種々の補体関連因子をそれぞれ反応させ,ウェスタンブロット法にて各種補体関連因子の分解を解析した.その結果,SpeBはC2,C3b,C4,C5a,C6,C7,C8,C9 および MAC をそれぞれ分解した.走査型電子顕微鏡を用いてヒト血清と反応させた野生株およびspeB 変異株の表層構造を観察したところ,ヒト血清と反応させたspeB 変異株では,野生株と比較して菌体表層構造の破壊が観察された (図1).フローサイトメトリーを用いて野生株およびspeB 変異株表層への膜侵襲複合体(membrane attack complex; MAC)もしくは補体第9因子(C9)の会合量を解析した.MAC は野生株とspeB 変異株の両株に会合したが,C9はspeB 変異株のみに会合した.
以上の結果から,S. pyogenesのSpeBは種々のヒト補体関連因子を分解し,ヒト補体活性化経路を阻害することが示唆された (図2).
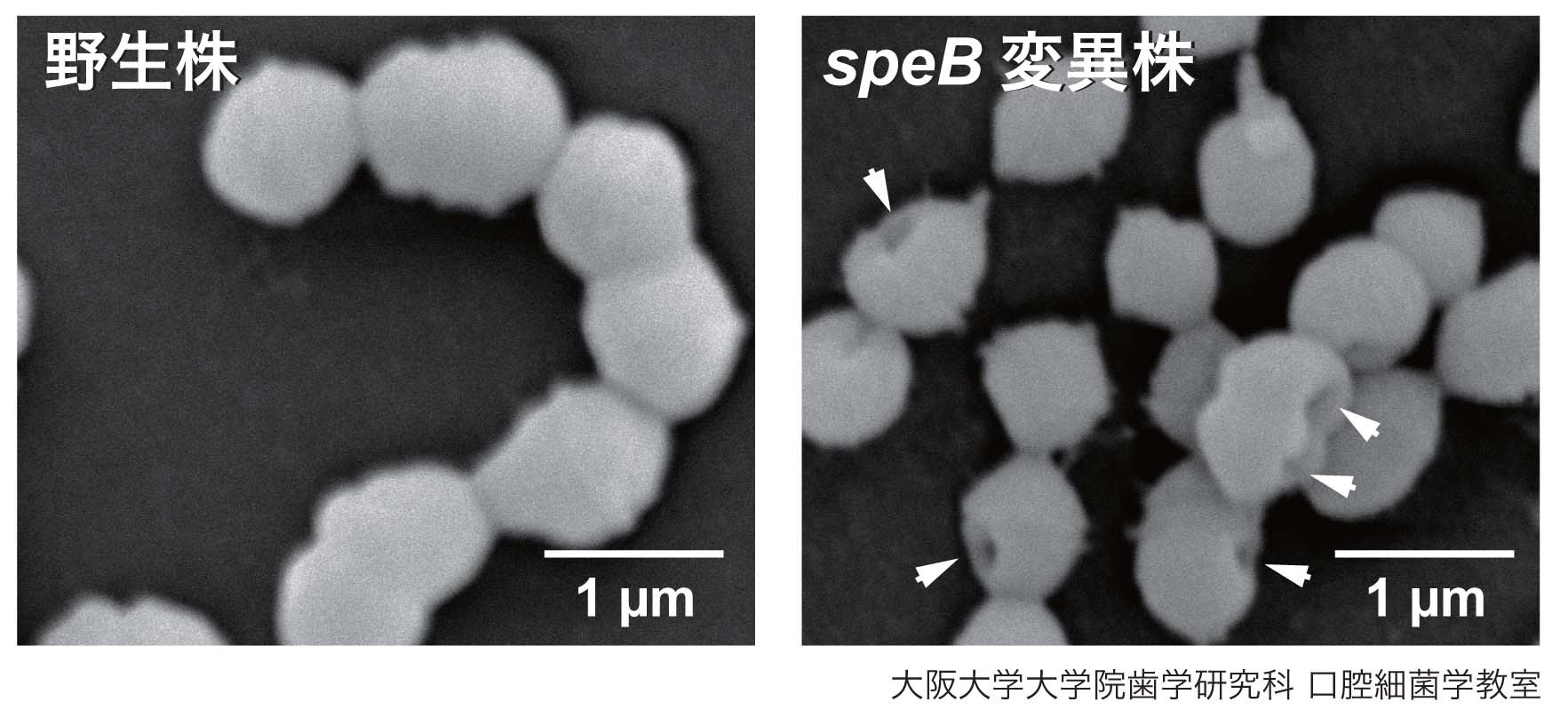
図1. ヒト血清と反応させた野生株およびspeB 変異株の菌体表層構造の走査型電子顕微鏡像.矢印部分にMACによる菌体表層への孔形成が確認された.
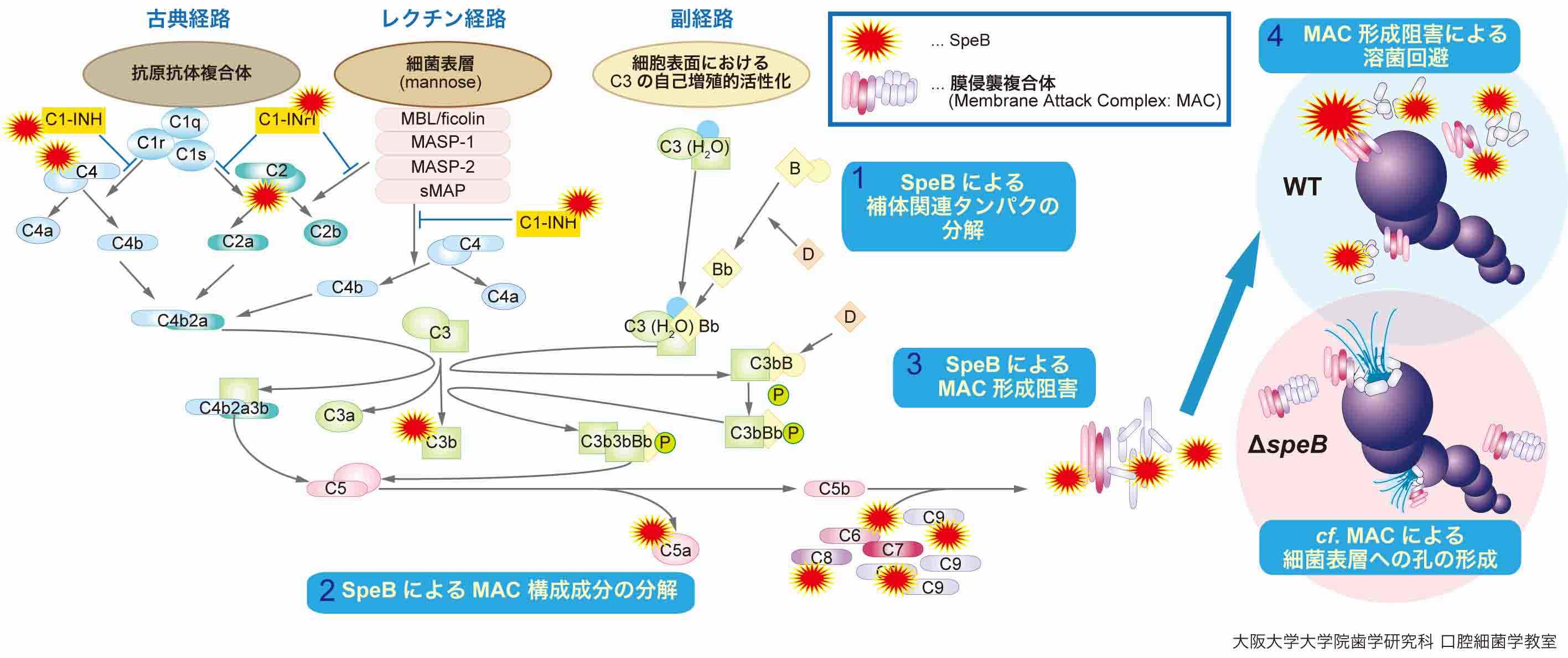
図2.化膿レンサ球菌のヒト補体免疫回避機構の推定モデル.化膿レンサ球菌の病原因子SpeBは補体関連タンパクを分解することでMACの形成を阻害し,MACによる溶菌作用を回避していると考えられる.
【参考文献】
Mariko Honda-Ogawa, Taiji Ogawa, Yutaka Terao, Tomoko Sumitomo, Masanobu Nakata, Kazunori Ikebe§, Yoshinobu Maeda and Shigetada Kawabata. Cysteine Proteinase from Streptococcus pyogenes Enables Evasion of Innate Immunity via Degradation of Complement Factors. J Biol Chem. 2013. 288(22):15854-15864.
z