インフルエンザに合併する細菌性肺炎の重症化機構の解明
インフルエンザは冬期に流行するウイルス感染症であり、日本国内だけでも年間1,000万人が罹患し、約1万人が重症肺炎により死亡する。肺炎が重症化する理由の一つとして、鼻咽腔に定着する肺炎球菌による細菌性肺炎の合併が挙げられる。しかし、ウイルス感染が細菌感染を助長させる詳細なメカニズムは明らかではなく、病因論に基づく有効な予防法と治療法の確立には至っていない。
我々の研究グループは、A型インフルエンザウイルス (IAV) 感染がもたらす気道におけるストレス応答分子群の表在化に着目し、小胞体(ER)に局在する分子シャペロンであるGP96がウイルス感染に伴い気道上皮表層に誘導されることを発見した。二次的に感染する肺炎球菌は菌体表層タンパク質であるAliAおよびAliBとGP96の相互作用を介して,ウイルス感染気道組織に定着する。また、IAV感染細胞では、GP96のシャペロン機能により、インテグリンalphaVというタンパク質の細胞表層での発現量が増加し、このタンパク質もまた肺炎球菌が気道に定着するための宿主レセプターとして機能することを証明した。
マウスにIAVを経鼻感染させた6日後に、肺炎球菌を経鼻感染させ、IAV-肺炎球菌の重複感染マウスモデルを構築した。細菌感染1日後の上気道および下気道におけるGP96の発現を定量RT-PCR法で解析した。非感染群および肺炎球菌単独感染群と比較して、IAV単独感染群では上気道においてのみGP96の顕著な発現上昇を認めた。一方、IAV-肺炎球菌重複感染群では上気道および下気道でGP96の発現量は上昇した。興味深いことに、GP96 のシャペロン機能を標的とする阻害薬 PU-WS13の経気道投与により、細菌の肺への定着、ならびに、重複感染マウスの肺組織で認められた炎症細胞の浸潤に伴う組織傷害は著しく抑制された(図1)。
したがって、IAV感染に伴い気道表層に誘導されるGP96は二次性細菌性肺炎の増悪因子として機能することが明らかになった。また、GP96は細菌性肺炎の発症と病態形成を制御できる有効な治療標的であることが示唆された。
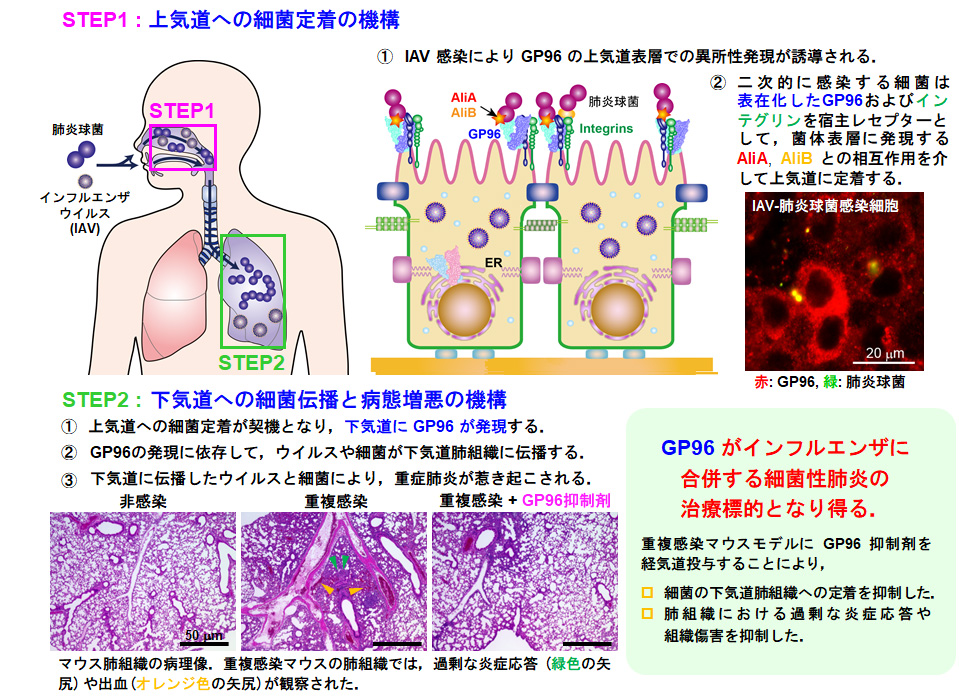
図1.インフルエンザに合併する細菌性肺炎の発症メカニズム
インフルエンザウイルスが上気道に感染すると、分子シャペロンであるGP96が細胞表層に誘導される。同時に、GP96のシャペロン機能によりインテグリンの細胞表層での発現量が増加する(STEP1の①)。肺炎球菌は、菌体表層に発現するAliAおよびAliBを介して、細胞表層のGP96やインテグリンに結合し、上気道に定着する(STEP1の②)。その後、上気道への細菌の定着が契機となり、下気道でのGP96の発現量が増加することにより、ウイルスと細菌が下気道に伝播する(STEP2の①、②)。下気道に到達したウイルスと細菌により、肺組織に過剰な炎症応答や出血などが惹き起こされ、重症肺炎の病態が形成される(STEP2の③)。
IAV感染細胞における上皮バリア機能障害と病態形成の関連を検証した。IAV感染肺胞細胞ではGP96のみならず、細胞内システインプロテアーゼであるカルパインもまた細胞表層、特に細胞膜領域に強く誘導されることを見出した。活性化に伴い細胞膜部位に誘導されたカルパインは上皮バリア機能の維持に重要なオクルディンやE-カドヘリンなどの細胞間接着分子群を分解する。また、IAV感染細胞では、細胞間接着分子群のリプレッサーであるSnail1の発現上昇と細胞間接着分子群の発現低下を認めた。したがって、IAV感染による異所性のカルパイン発現およびSnail1の転写誘導は宿主上皮のバリア機能を障害し、ウイルス感染気道上皮に定着した細菌の細胞間隙部位からの上皮バリア突破を亢進させることで重症肺炎が惹起されると推察した。
【参考文献】