研究内容
INDEX
- I. 硬組織の発生・維持における細胞運命決定機構の理解と応用
- II. 新規分泌蛋白C1qTNF3に関する研究
- III. 顎顔面・四肢骨格形成に必須の因子の同定
- IV. 味覚および口腔内感覚全般に関する神経生物学的研究
I. 硬組織の発生・維持における細胞運命決定機構の理解と応用
本テーマでは、組織発生過程の正しい理解が組織再生・修復への近道であるという考えのもと、骨格系(骨・軟骨)や歯といった硬組織に着目して、①「発生・維持機構に関する基礎的知見の集積」と、②「組織再生・修復療法の基盤技術開発」の二つを研究の基本方針とします。具体的には、遺伝子発現制御やエピゲノム動態の観点から細胞運命決定機構を理解し、それに基づく組織再生・修復戦略のproof of conceptの提示を目指します。ゲノムワイド解析・バイオインフォマティクス解析を適宜取り入れながら、形態学、発生生物学、分子生物学、幹細胞生物学、マウス遺伝学、生体工学の統合的アプローチにより研究を推進します。以下の3つのプロジェクトを中心に進めます。
A) 細胞運命決定機構におけるエピゲノム動態、遺伝子制御ネットワーク
エピゲノム動態と転写因子のゲノム標的に着目することで、遺伝子転写機構の観点から、骨格(骨・軟骨)発生過程における細胞運命決定・分化・成熟のメカニズムを明らかにすることを目指しています。遺伝子発現とエピゲノム状態・転写因子結合領域に関するゲノムワイドデータを駆使して、骨や軟骨を形成する細胞(骨芽細胞、軟骨細胞)を規定するゲノム制御の全体像(regulatory
landscape)の解明に取り組んでいます。これまでに、多能性幹細胞の未分化状態と分化を規定する転写因子ネットワークや (Stem Cells
31:2667, 2013)、骨芽細胞や軟骨細胞を特徴づけるエピゲノム動態や分化に関わるマスター転写因子の作動様式、さらにはそれらが構築する遺伝子制御ネットワークの一端を明らかにしてきました
(Cell Rep 12:229, 2015; Dev Cell 37:238, 2016; Development 143:3012, 2016;
Trends Genet 32:774, 2016; Cell Rep 40:111315, 2022; Cell Rep 42:112276, 2023)。また、骨格形成に関わるシグナル経路としてヘッジホッグ(Hedgehog: Hh)シグナルに着目し、骨形成性細胞への運命決定や骨組織の維持におけるHhシグナルの役割を明らかにしてきました
(Development 131:1309, 2004; Dev Cell 14:689, 2008; J Biol Chem 287:17860,
2012; J Biol Chem 288:9924, 2013; PLoS ONE 9:e109597, 2014)。一連の研究を通じて骨・軟骨の細胞運命決定機構が正しく理解できれば、その機構を操作することで骨・軟骨の再生や修復を促す手法の開発につながります。
B) 多能性幹細胞を用いた組織発生モデリングシステム
あらゆる組織に分化できる能力(多能性)と自己複製能をもつ多能性幹細胞(胚性幹細胞-ES細胞、人工多能性幹細胞-iPS細胞)は有望な研究ツールと考えられます。多能性幹細胞を用いて、正常な発生過程と生体内での代謝をインビトロでモデリングすることができれば、治療薬開発や再生医療のみならず、疾患の理解、組織形成と維持のメカニズムの理解につながります。そこで、マウスやヒトの多能性幹細胞から、正常な骨格発生過程を模倣しながら骨格系細胞を作製する方法を開発しています(Stem Cell Reports 2:751, 2014; Regen Ther 14:19, 2020; Cell Rep 42:112276, 2023; Regen Ther 24:536, 2023)。さらに、骨芽細胞・骨細胞・破骨細胞という骨の形成と維持を制御する細胞が三次元的に機能する骨様組織を、多能性幹細胞を用いて培養皿上・試験管内で作製し、骨代謝をモデリングする方法の開発にも取り組んでいます(Sci Adv 3:e1602875, 2017)。
C) 骨・軟骨形成を誘導する生理活性物質
骨・軟骨形成は様々なシグナル経路や転写因子によって制御されています。その中で特に重要な経路や因子を操作することで、骨や軟骨の形成・再生や、組織変性の抑制が可能となると考えられます。この観点から、マウス遺伝学的手法や分子生物学的手法を駆使しながら、骨形成性シグナルや軟骨形成性シグナルの作動機序と骨・軟骨形成を誘導する生理活性物質の同定・応用に取り組んでいます。Hhシグナルに関する基礎的知見に基づいて、これまでにHhシグナルを活性化する低分子SAGを用いた骨折治療(Biochem Biophys Res Commun 479:772, 2016)や、SAGを搭載したリン酸カルシウム人工骨による骨再生療法(Biomaterials 34:5530, 2013)について報告してきました。また、骨形成性低分子化合物として新規に同定したヘリオキサンチン類縁体THは市販に至っております (Biochem Biophys Res Commun 357:854,2007; https://www.tcichemicals.com/eshop/ja/jp/commodity/M3085/)。
| (学外共同研究先) |
|---|
| ■東京大学 |
| ■長崎大学 |
| ■東北大学 |
| ■東京歯科大学 |
| ■東京医科大学 |
| ■昭和大学 |
| ■コネチカット大学医療センター |
| ■株式会社ファーマフーズ |
| ■株式会社理論創薬研究所 |
II. 新規分泌蛋白C1qTNF3に関する研究
当教室で軟骨組織から同定された分子量26-kDaの分泌蛋白は、メタボリックシンドロームとの深い関わりを指摘されているアディポネクチン(脂肪組織から分泌される分子量30-kDaのホルモン)とよく似た構造をもち、アディポネクチンなどとともに15種類ある「C1q/TNFスーパーファミリー」蛋白に属することがわかりました。この蛋白は現在C1qTNF3とよばれ、骨格系の成長や糖代謝、炎症に関わっていることが報告されています。また、C1qTNF3は血液中にも含まれており、体内を循環していることが明らかになっています。しかしながら、その役割についてはまだ不明な点が多く残されています。我々はC1qTNF3の生理的役割および疾患における役割のさらなる解明をめざして、細胞レベルの解析と遺伝子改変マウス(図1)を用いた個体レベルの解析の両面からのアプローチで研究に取り組んでいます。

図1:キメラマウス(混色)と野生型マウス(黒)
III. 顎顔面・四肢骨格形成に必須の因子の同定
骨格器系は力学的な支柱としての作用だけでなく、造血やホルモン産生など生命にとって重要な役割を担っています。我々はこの重要な器官系の形態形成の分子メカニズムを個体レベルで解明しようと考えています。
- 1.
- 顎顔面は多数の骨や筋肉からできる、かなり複雑な構造です。しかし、たとえ人種が異なっても最終的に出来上がる形態は極めて類似しています。この点から、複雑な構造である顎顔面の発生様式は比較的単純なルールを頑強に守ることで、設計図のミスの発症頻度を少なくしていると考えられます。その際、大切なのが司令塔となる「親分(遺伝子)」の役割です。この親分遺伝子の指令をその他の細胞が(何も考えずに)聞くという単純なルールを頑強に守ることで、設計図のミスを少なくしているのです。我々は顎顔面発生における、この「親分遺伝子」の同定を試みています。これまでに上顎と下顎の境界部分の形成に必須の転写因子であるGATA3やTRPS1を同定してきました。
- 2.
- 骨の形態は隣接する骨に面した関節、長いシャフト、そして骨の内部には臓器のひとつとも考えられる「骨髄」が形成されます。肘や膝、指の関節形成の分子メカニズムはかなり知見が蓄積してきているのに対して、肩関節、股関節、顎関節などの正常発生の分子メカニズムはいまだに未解明の部分が多いのが現状です。肩関節と股関節は同じように肢と胴体の連結部という印象を受けますが、その関節部分を構成する骨格の由来は大きく異なり、またその発生に関わる因子がそれぞれの関節で異なることも知られています。我々は現在、股関節の正常発生に寄与する因子を見出し、詳細な解析を行っています。骨髄は造血の場として重要ですが、様々な間葉系幹細胞を蓄えている点でも重要です。我々は個体レベルで骨髄形成に関わる因子の一つとして転写因子であるKLF4を同定してきました。
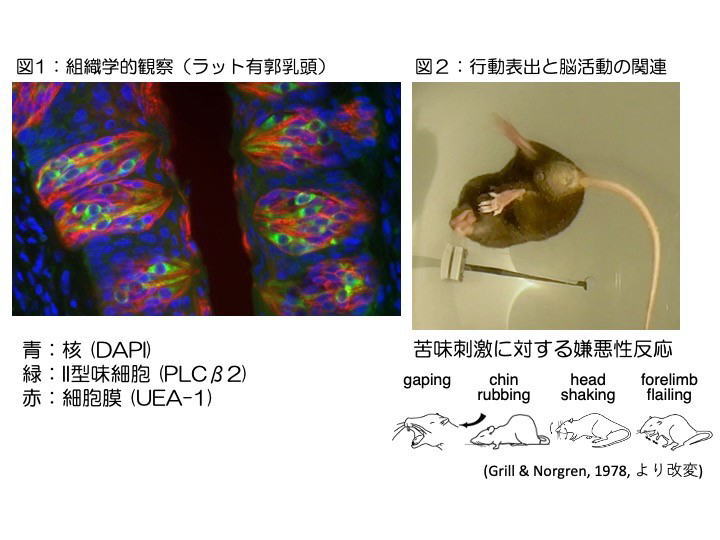
IV. 味覚および口腔内感覚全般に関する神経生物学的研究
歯科においては口腔における咀嚼機能の回復・維持が重要となります。食べ物を咀嚼することで、口腔内において触覚、温覚、味覚などの感覚器が働きます。これらの感覚によって食べ物の「おいしさ」が感じられます。 味覚は、甘味、うま味、塩味、酸味、苦味の5基本味(現在では、脂味、こく味など受容体があることもわかっています)はそれぞれが生物学的な意義をもち、摂食の可否を判断する大切な情報源となっています。例えば、甘味はエネルギー源、うま味はアミノ酸の栄養、塩味はミネラルとしての情報をもち、生体に有益であることを示します。一方、酸味は腐敗物、苦味は毒物としての情報をもち、生体にとって有害であることを示します。これらの味を呈する物質は舌背、軟口蓋、咽頭、喉頭に分布する味蕾内の細胞にある受容体に結合した後、神経を介して脳に伝達され、最終的に味として認知されます。
近年、味覚障害を訴える患者が増加しています。高齢化社会がその増加に関係しているとも考えられています。味覚障害によって味を感じにくくなると、味の濃いものを食べるようになるなど食べ物の嗜好性に偏りが生じ、これが長期にわたると偏食、食欲減退、生活習慣病などに至る可能性も高まります。
このような加齢に関連する味覚機能の低下の仕組みを明らかにするため、遺伝子から個体レベルまで様々な視点からの解析を試みています。現在は以下のような研究に取り組んでいます。1)味覚異常を引き起こす原因の一つに体内の亜鉛量の低下が挙げられています。そこで、低亜鉛状態によって味覚異常を生じるモデル動物や老化モデル動物を用いて、末梢受容器の味蕾(図1)の組織構造、神経機能、脳、行動(図2)について関連を調べています。また、2)味細胞と同じ機能を持つ細胞が口腔以外の様々な臓器に存在していることが明らかになってきていますので、全身性の味細胞の発現様式について遺伝子レベルで調べ、様々な病態との関連を調べています。味覚異常はどのような病気との関連があるか、病気の予防、また病態に応じた回復方法の開発を目指すことで、誰もが食べ物を美味しく感じ、健康を実現させることができる世界を目指しています。
バナースペース
大阪大学大学院歯学研究科
組織・発生生物学講座
(旧 口腔解剖学第一教室)
〒565-0871
大阪府吹田市山田丘1-8
TEL 06-6879-2874
FAX 06-6879-2875






